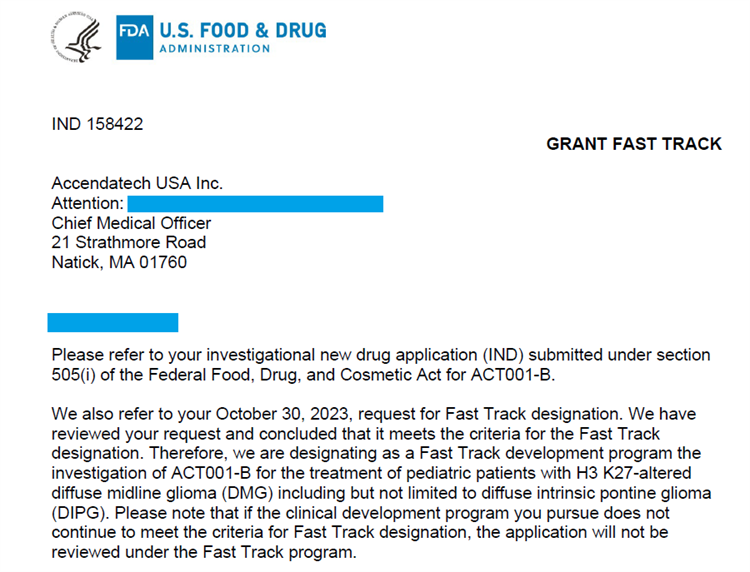
南开新闻网讯(记者 南辛文)记者获悉,12月20日,南开团队原创新药ACT001获得美国食药监局(FDA)快速通道资格(Fast Track Designation,FTD),用于治疗儿童弥漫性中线胶质瘤(DMG)包括但不限于弥漫性内生型桥脑胶质瘤(DIPG)。
美国食药监局快速通道资格的设立,旨在促进或加速针对严重或危及生命的疾病,且当前尚未有能够满足临床需求治疗手段的药物研发过程,使药物能够尽快获批上市。这是ACT001获得3项欧美孤儿药资格,1项儿童罕见病资格(中国首个)后,又一次获得更为重要的海外临床试验支持政策与资质。
据了解,ACT001由南开大学陈悦团队原研,尚德药缘集团执行临床前、临床转化与产业化。截至目前,ACT001已获得全球10余项临床批件,并有多项II期临床试验结果公布。目前用于儿童脑干胶质瘤(DIPG)的II期临床试验,由首都医科大学附属北京天坛医院放疗科邱晓光教授牵头,并在全国10家参研中心开展。ACT001联合全脑放疗用于肺癌脑转移的2b/3期临床试验,由山东第一医科大学附属肿瘤医院的于金明院士牵头,在全国20多家参研中心开展。
|