南开新闻网讯(记者 南辛文)记者获悉,3月15日,南开大学饶子和院士团队/上海科技大学张璐团队在国际微生物领域权威期刊《自然•微生物学》(Nature Microbiology)在线发表了一项国际联合研究成果,率先报道了结核分枝杆菌全新药物靶标——膜蛋白磷酸核糖转移酶Rv3806c的冷冻电镜三维结构。该成果分别解析了Rv3806c与其受体底物和供体底物结合复合物的精细三维结构,揭示了该蛋白在细菌质膜上催化磷酸核糖转移的分子机制,为研究Rv3806c作为新靶点的靶向性药物研发提供了重要的理论基础。
结核病由细菌性病原体结核分枝杆菌(Mtb)感染引起,每年造成千万人感染,百万人死亡,是包括我国在内的全球重点防控的慢性传染病。抗结核新靶标的发现和功能机制研究是抗结核药物开发的关键。在抗结核靶标通路选择策略上,靶向细胞壁通路的药物被同时用于治疗敏感结核病和耐药结核病,是国际公认的抗结核最有效的策略,因此细胞壁通路关键酶也是国际上竞相追逐的研究热点。
磷酸核糖焦磷酸(PRPP)是生物体内的关键代谢物分子,广泛参与到核苷酸、氨基酸和辅因子(NAD/NADP)等生物分子的生物合成,这些过程是由磷酸核糖转移酶(PRTases)在细胞质中以PRPP为底物催化完成。而在Mtb中存在一种独特的膜蛋白PRTase,Rv3806c,是细胞壁阿拉伯糖基供体癸异戊烯基磷酸阿拉伯糖(DPA)合成通路关键酶。它负责催化将PRPP的磷酸核糖基转移到膜锚定的癸烯基磷酸(DP)中,生成DPA的前体癸异戊烯基-1-磷酸-β-核糖基-5-磷酸(DPPR)。DPA是糖基转移酶C(GT-C)超家族在细胞壁合成中所利用的唯一阿拉伯糖基供体,其参与的细胞壁合成通路已被证实是一线抗结核药物乙胺丁醇的作用靶标,因此Rv3806c也被认为是极具潜力的抗结核新靶标,其功能机制研究有望为解决日益严重的耐药结核提供新思路。
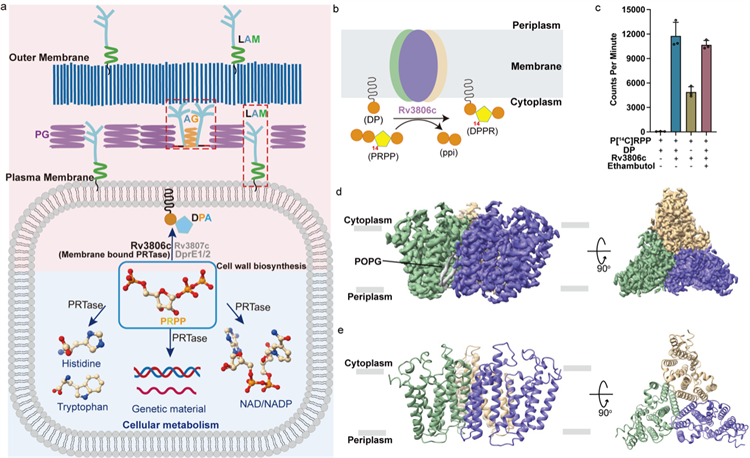
图1 Rv3806c功能和整体结构
(a)Mtb中PRPP参与细胞代谢和细胞壁生物合成示意图。
(b) Rv3806c在细胞膜上催化磷酸核糖转移的反应示意图。
(c)放射性同位素标记的PRTase体外酶活实验。
(d,e) Rv3806c三聚体的冷冻电镜电势密度图和卡通模型。
研究团队分别解析了Rv3806c与受体底物DP和供体底物PRPP的两个复合物结构。冷冻电镜结果显示在脂质环境中Rv3806c以三聚体形式组装。随后的功能实验揭示Rv3806c的三聚体组装形式对于其发挥PRTase功能起到重要作用,也证实了在分枝杆菌天然细胞质膜上Rv3806c以三聚体形式存在。每个单体由9根跨膜螺旋(TM helices)组成,TM 1-5 和TM 6-9分别形成两个螺旋束,螺旋之间由4个细胞外质环(PLs)和4个细胞内质环(CLs)连接,CL1-3在跨膜区上方形成帽子结构。结构和功能研究揭示两个螺旋束和细胞质侧帽子结构负责结合底物。受体底物DP结合在螺旋束-2的疏水空腔,供体底物PRPP通过一个Mg2+结合在TM螺旋束-1的空腔。结合亲和力实验显示Mg2+和核糖基团对于PRPP的结合至关重要。体外PRTase酶活实验显示PRPP焦磷酸上的β-磷酸和末端5′-磷酸在Rv3806c活性中起关键作用。
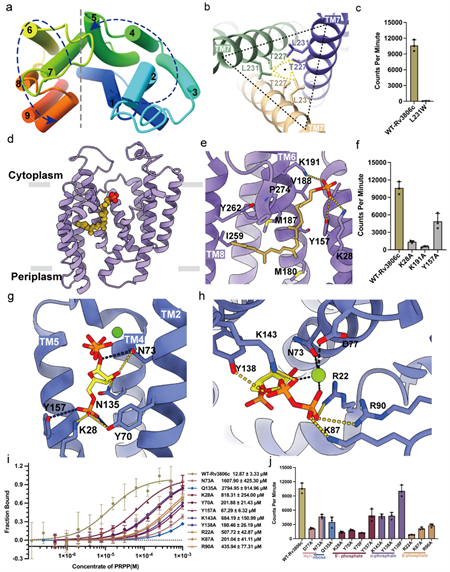
图2. Rv3806c的详细复合物结构与功能
(a)Rv3806c逆时针方向的TM排列,由两个螺旋束组成。
(b)由TM7介导的三聚体界面和相互作用氨基酸。
(c)三聚体界面氨基酸突变体的PRTase体外酶活结果。
(d-e)受体底物DP结合在螺旋束-2的空腔和相互作用氨基酸示意图。
(f) DP结合位点氨基酸突变体的PRTase外体酶活结果。
(g-h)受体底物PRPP结合在TM螺旋束-1的空腔和结合位点示意图。
(i-j)PRPP结合位点氨基酸突变体的结合亲和力和PRTase外体酶活结果。
通过两个结构的对比发现,PRPP的结合导致CLs发生了不同程度的构象变化,使得位于细胞质一侧的帽子结构域进一步关闭,从而形成反应的活性中心并阻止细胞质中的溶剂流向催化中心,这也是包括可溶性PRTase在内的该家族酶类采取的一种通用策略。通过叠加比对两个复合物结构发现,DP中磷酸的氧原子与PRPP的核糖异头碳C1原子距离较近(4.5 Å)。DP中磷酸位于离去基团PPi的对侧,满足亲核试剂DP的磷酸从背面攻击PRPP核糖C1原子,即“反转式(inverting)”亲核取代,该反应将供体PRPP核糖的α构型转化为产物DPPR核糖的β构型。
该工作还通过结构和功能研究,解释了临床在Rv3806c上突变造成乙胺丁醇耐药的机制,表明位于三聚体界面的磷脂结合位点通过一种可能的变构调节机制影响三聚体的PRTase,从而介导临床乙胺丁醇耐药。
据介绍,南开大学生命科学学院2022级博士研究生高珊和2020级博士研究生吴方羽为论文第一作者。南开大学为论文第一完成单位。上海科技大学免疫化学研究所张璐研究员、饶子和院士和英国伯明翰大学Gurdyal S. Besra院士为论文共同通讯作者。该成果受到自然科学基金委重大项目、上海科技大学、广州国家实验室、上海市生物大分子与精准医药前沿科学研究基地和上海市临床研究中心的资助。
电镜数据收集在上科大生物电镜中心完成。此项工作是张璐/饶子和团队和伯明翰大学Gurdyal S. Besra联合攻关团队继揭示一线药物乙胺丁醇靶点蛋白EmbA/B/C分子机制(Science, 2020),解析AG合成通路起始阿拉伯糖合成的关键酶AftA精细三维结构(PNAS, 2023)之后,聚焦抗结核细胞壁合成全新靶点的又一项重要成果,为系统性理解Mtb独特复杂的细胞壁组装的分子机制和靶向细胞壁的抗结核新药发现提供了结构基础。
论文链接:https://www.nature.com/articles/s41564-024-01643-8
相关成果链接:
https://www.science.org/doi/10.1126/science.aba9102
https://www.pnas.org/doi/10.1073/pnas.2302858120
|