南开新闻网讯 低氧微环境成为实体瘤最为显著的特征之一,与很多信号通路共同调控肿瘤细胞的功能,如促进细胞增殖、血管生成、代谢重编程、浸润转移,和放化疗抵抗等。同时低氧微环境应激在调控转录调控、表观遗传调控、蛋白质翻/翻译后修饰调节等在内十分复杂的细胞活动,其中关键蛋白质的泛素化修饰在低氧应激信号通路中发挥了十分重要的作用。因此肿瘤细胞低氧应答中发挥关键作用蛋白底物的泛素化修饰动态调控机制仍需要进一步发掘。
近日,南开大学生命科学学院、药化生国家重点实验室、细胞应答交叉科学中心朱玉山教授团队在eLife杂志上在线发表了题为“Hypoxia-induced proteasomal degradation of DBC1 by SIAH2 in breast cancer progression”的研究成果。该研究发现,低氧应激可以通过调控关键肿瘤调控因子DBC1(Deleted in Breast Cancer 1)蛋白发生泛素化修饰降解进而影响肿瘤进展的分子机制,从新的角度揭示了低氧微环境调控肿瘤细胞应答的分子机理。

DBC1通过直接结合抑制或者间接影响转录的方式调控多种信号通路活性,在 DNA 损伤修复、肿瘤细胞生长迁移和细胞凋亡等活动中发挥着关键作用,其功能活性对于维持机体稳态具有重要意义。DBC1自身功能受多种翻译后修饰影响,如磷酸化、乙酰化、SUMO化等等。但是,DBC1是否发生泛素化修饰及其蛋白稳定性的调控机制还处于未知。
在此项工作中,研究团队首先通过比对分析常氧和低氧条件下乳腺癌细胞的RNA-seq,发现低氧应激条件下受DBC1正向调控的信号通路活性显著下降。同时生化实验研究证实,低氧应激可以诱导DBC1发生泛素化修饰,并通过蛋白酶体途径降解从而参与调控下游信号通路。通过质谱分析和生化实验验证,筛选并分别鉴定出调控DBC1泛素化修饰的E3泛素连接酶SIAH2和去泛素化酶OTUD5。分子机制研究发现,在低氧应激诱导OTUD5与DBC1相互作用能力减弱,同时 SIAH2竞争性结合DBC1,并催化其287位赖氨酸残基发生泛素化修饰和蛋白酶体途径降解。最后在在临床组织样本中证实SIAH2与DBC1蛋白水平在乳腺癌病人样本中呈负相关,DBC1的蛋白水平与癌症病人的临床分期和病理分级具有显著相关性。
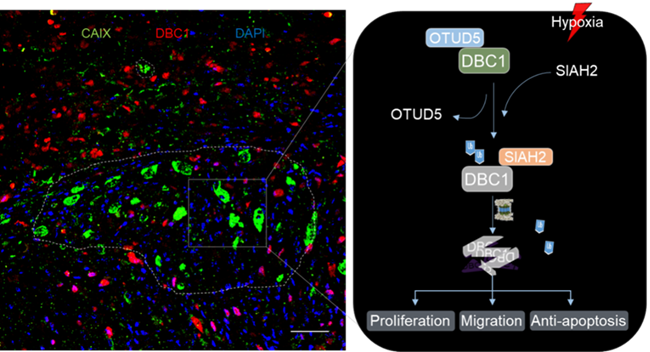
因此,该研究丰富了低氧微环境通过影响肿瘤细胞中关键蛋白因子的泛素化修饰和蛋白稳定性动态调控机制,进而影响肿瘤的发生发展;阐明了关键肿瘤调控因子DBC1的蛋白稳定性在肿瘤细胞抵抗不良环境以及乳腺癌发生发展中的重要作用,并为乳腺癌的预防和治疗提供了新的靶点和策略。
南开大学生命科学学院博士研究生刘强强为论文的第一作者,南开大学朱玉山教授为该论文的通讯作者,南开大学统计与数据学院的胡刚教授团队在RNAseq数据分析提供技了术支持。该研究工作获得了国家自然科学基金重点项目、科技部国家重点研发计划项目的资助。(生命科学学院供稿)
全文链接:https://elifesciences.org/articles/8124
|