南开新闻网讯(记者 吴军辉)由南开大学化学学院陈悦教授历时11年研发的原创候选新药ACT001正在中国、澳洲和美国开展临床试验,适应症包括恶性脑胶质瘤这一世界医学难题。日前,主持试验的多位中外医生,先后在美国临床肿瘤学会(ASCO)与神经肿瘤学会(SNO)的学术会议上,公布了ACT001的部分临床试验结果:初步证明该候选新药安全、有效,其中一例复发脑胶质母细胞瘤(GBM)患者单药治疗超50个月,维持完全缓解状态超27个月。
ACT001是由陈悦教授课题组创制的新结构小分子化合物,其制备原料为小白菊内酯,最早从西方国家传统草药小白菊中提取。小白菊内酯对肿瘤干细胞具有选择性杀灭作用,但它在小白菊中含量极低。陈悦课题组进行了大量探索,最终发现我国特有植物辛夷(山玉兰)的根皮中小白菊内酯含量高达9.6%,实际提取率稳定在5%~6%。通过半合成手段,该团队对小白菊内酯进行了化学结构改进,获得DMAMCL(即ACT001)。这种小分子化合物口服即可进入血液,并可突破血脑屏障,直接作用于脑部肿瘤病灶。
ACT001具有完全自主知识产权,目前已获得二十余个国家的专利授权,2017年获美国药监局与欧盟药监局“孤儿药”资格认证,先后在澳大利亚、中国、美国开展临床试验,其中6项为临床2期或者1b/2a,2项为儿童肿瘤1期临床,适应症包括:脑胶质母细胞瘤、儿童弥漫性内生性脑桥胶质瘤、癌症脑转移瘤、视神经脊髓炎与肺纤维化。
在ASCO今年6月召开的学术会议中,澳大利亚Nucleus Network医院的Jason Lickliter教授、天津肿瘤医院王平教授以墙报的形式分别介绍了ACT001治疗复发胶质母细胞瘤(GBM)的临床试验结果。
GBM被世界卫生组织(WHO)评级为IV级,是恶性程度很高的颅内胶质瘤,复发率高,中位生存期不到2年,长期生存率约为4%。目前,治疗GBM的标准药物只有替莫唑胺,但其只能延长患者中位生存期2.5个月。在成人的复发GBM中,Lickliter教授报道了免疫调节剂ACT001优异的安全性,以及长期生存的病例:2017年3月,一位澳洲复发GBM患者,加入澳洲临床试验,入组时颅内瘤体大小接近4厘米,经过ACT001单药长期治疗,2018年10月达到完全缓解。截至目前,该患者已用药超过50个月,依然是完全缓解状态。Lickliter教授介绍,ACT001联合PD-1免疫药治疗复发GBM的临床试验也在进行。
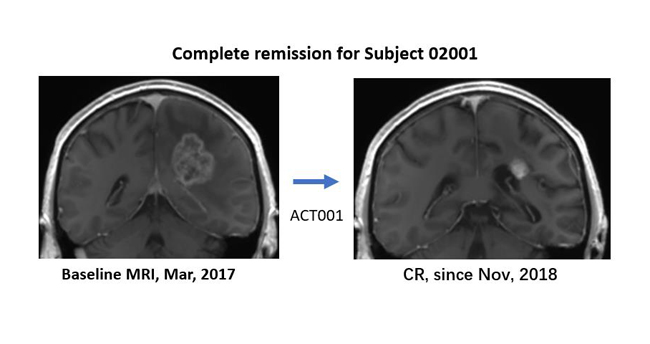
左图:复发GBM患者入组前核磁影像(2017年3月),瘤体接近4cm。
右图:该患者ACT001单药治疗后的核磁影像,自2018年11月以来,达到完全缓解。
目前,中、美、澳的临床试验疗效评估标准已统一修改为肿瘤免疫药的常用标准iRANO。天津市肿瘤医院王平教授的研究结果显示,出组的患者大都是症状稳定的情况,其中一位患者通过穿刺病理检查发现,其新发病灶中没有肿瘤细胞,而是小神经胶质细胞与巨噬细胞,且该患者也获得了较长的生存期。他们的研究进一步证实了ACT001通过免疫机制发挥抗癌作用。
新南威尔士大学悉尼儿童癌症中心的David Ziegler教授团队,在SNO会议中以讲座报告介绍了ACT001治疗儿童弥漫性内生性脑桥胶质瘤(DIPG)的临床试验结果。DIPG属于儿童脑干肿瘤,手术无法切除,没有获批的标准治疗药物,中位生存期不到1年,长期生存率不足1%,是最难治的恶性肿瘤之一。
David Ziegler教授团队报道了通过超高剂量的ACT001治疗,2位DIPG或者弥漫性中线胶质瘤DMG患儿身上出现临床反应。其中,一位患者的肿瘤细胞密度大幅降低,临床症状评分(KPS评分)从50提升到90,说明该患者的临床症状与身体状况有大幅好转。
图A:入组前核磁影像,红圈内显示有大量的弥漫性病灶。
图B:ACT001单药治疗后影像,肿瘤细胞密度大幅降低。
“优异的安全性、长期完全缓解的病例,以及免疫调节作用机制证据的发现,这些临床试验结果令我们十分振奋,尤其是针对DIPG这种恶性程度极高的肿瘤,澳洲的安全有效性结果是在超高剂量下取得的,这也给了我们提示:其它恶性肿瘤也可以考虑尝试超高剂量。”陈悦说。
陈悦介绍,ACT001的潜在用途不仅局限于脑胶质瘤的治疗,团队还发现ACT001能够提高辐射后动物的生存率,现已申请了其放疗保护的用途专利。此外,科学界同行还陆续发现ACT001在治疗多种炎症、癌症与纤维化方面的用途。
“目前开展的8项临床试验中,澳洲肺纤维化临床2期与中国联合放疗治疗癌症脑转移瘤的临床试验入组接近完成,合作企业尚德药缘集团正在大力推动注册性临床试验与3期临床试验。”陈悦说。
值得关注的是,ACT001临床试验药品的用量急剧上升,小白菊内酯及辛夷(山玉兰)根皮的需求量也随之大幅增加。合作企业在多地设立辛夷树种植示范基地,推动辛夷树种植产业的发展,在支持科学研究的同时也一定程度上实现了助农增收的良好社会效益。
据了解,ACT001的成果转化,先后获得国家“十二五”、“十三五”新药创制重大专项与天津市抗癌重大专项的支持。ACT001的全球临床试验与成果转化,除合作企业尚德药缘集团全力推动以外,也获得了天津市科技局、天津市外专局、天津市科协等部门,以及河南、江苏、内蒙古、安徽、广东等地方政府的大力支持。
相关链接:
ASCO会议墙报: https://meetinglibrary.asco.org/record/196587/abstract
ASCO会议墙报: https://meetinglibrary.asco.org/record/196574/abstract
SNO会议报告:
https://app.oxfordabstracts.com/events/1809/program-app/submission/233921
|